Bluttests könnten Diagnostik für seltene Erbkrankheit revolutionieren
Um ihre Forschung zu erklären, muss Isabelle Weinhofer vom Zentrum für Hirnforschung der Medizinischen Universität Wien weit ausholen. Denn die Krankheit mit dem komplizierten Namen X-chromosomale Adrenoleukodystrophie, kurz X-ALD, ist nicht nur weitgehend unbekannt. Sie ist auch medizinisch, diagnostisch und therapeutisch kompliziert.
X-ALD ist eine genetische Erbkrankheit. Mit einem Auftreten von 1:14700 in der Gesamtbevölkerung gehört sie zu den seltenen Erkrankungen. Auf Österreich hochgerechnet sind das rund 620 Betroffene; viele bleiben allerdings undiagnostiziert.
Durch Mutationen in einem bestimmten Gen, dem ABCD1-Gen, schafft es der Körper nicht, die selbst produzierten gesättigten überlangkettigen Fettsäuren („very long-chain fatty acids“) wie bei Gesunden abzubauen. Die Lipide reichern sich im Gewebe, vor allem im Gehirn und Rückenmark an, was zu toxischen Entzündungen und neurologischen Schäden führt.
Die Ausprägung der Symptome kann sehr unterschiedlich sein – das erschwert die Diagnostik der seltenen Krankheit. Während Frauen, die die Genmutation tragen und vererben, nur leicht betroffen sind und oft erst zwischen 50 und 60 Jahren (meist leichte) Symptome entwickeln, erkranken Männer immer, außerdem früher und schwerer.
Zerebrale Adrenoleukodystrophie (CALD)
CALD ist eine seltene, erbliche Stoffwechselerkrankung, die das Gehirn und das Rückenmark schädigt. Die Blut-Hirn-Schranke wird durchlässig und es werden Entzündungsprozesse im Gehirn ausgelöst. Durch eine Genmutation eines X-Chromosoms erkranken Männer immer. CALD tritt üblicherweise bei Buben zwischen 6 und 12 Jahren auf, es kommt zu schweren motorischen und neurologischen Schäden. Die Prognose für Betroffene hängt von einer frühzeitigen Diagnose und Behandlung ab.
Hirnschädigender Typ bei Buben unter 12 Jahren
Knapp die Hälfte von ihnen entwickelt zwischen 20 und 30 Jahren eine langsam fortschreitende Adrenomyeloneuropathie (AMN), die zu motorischen Problemen und Gehstörungen führt. Hochdramatisch hingegen verläuft die hirnschädigende Form der ALD: die zerebrale ALD (CALD).
Sie beginnt üblicherweise zwischen 6 und 12 Jahren, am Anfang oft unspektakulär: Die Buben wirken plötzlich sehr ungeschickt – stoßen sich an Möbeln, stolpern und sind unaufmerksam. Sie tun sich schwer beim Lesen, Schreiben und Verstehen von Geschriebenem. Manche werden aggressiv oder hyperaktiv. Die Literatur nennt eine Reihe weiterer Symptome wie Schluckstörungen, Schielen, Hör- und Sehverlust. Fehldiagnosen wie ADHS oder „psychische Probleme“ sind relativ häufig.
Die Symptome sind Zeichen dafür, dass sich die schützende Myelinschicht um die Nervenfasern auflöst: Die wichtige Blut-Hirn-Schranke wird durchlässig, aktivierte Immunzellen können ins Gehirn eindringen und lösen eine selbstverstärkende Schleife aus Entzündungsprozessen und Myelinabbau aus.
Wird die aggressive Form der ALD nicht sofort – bzw. möglichst früh – erkannt und behandelt, verschlechtert sich der Zustand der Buben rapide. In wenigen Monaten sind sie bewegungsunfähig bis komatös und versterben meist binnen ein bis drei Jahren.
Virus ein möglicher Auslöser von zerebraler ALD?
Was genau den dramatischen Verlauf auslöst, ist noch nicht geklärt. „Es gibt eineiige Zwillinge, von denen nur einer eine CALD entwickelt hat“, erzählt Weinhofer, die seit vielen Jahren zu X-ALD forscht. „Das zeigt, dass es neben der Genmutation auch andere Auslöser braucht.“ Eine Möglichkeit könnte ein Virus sein – Hinweise dazu gibt es aus der Multiple-Sklerose-Forschung (Anm.: MS ist die häufigste demyelinisierende Krankheit). Weil das Zeitfenster, in dem die Buben Symptome entwickeln, so scharf begrenzt ist, wären auch hormonelle Zusammenhänge plausibel.
Heilung für die Krankheit gibt es keine. Rechtzeitig erkannt, kann lediglich die weitere Verschlechterung mit einer Knochenmarkstransplantation gestoppt werden. Falls keine passende Spende gefunden wird, steht in manchen Ländern eine (sehr teure) Gentherapie zur Verfügung.
Ergänzend sei erwähnt: X-ALD ist durch den Film „Lorenzos Öl“ berühmt geworden. Das von Lorenzo Odones Eltern patentierte Öl kann die Werte der überlangkettigen Fettsäuren im Körper der Kranken normalisieren, den Ausbruch der Krankheit jedoch nicht verhindern. Der klinische Nutzen ist deshalb umstritten. Die routinemäßige Anwendung wird in internationalen Leitlinien nicht empfohlen.
„Zeit ist nach Beginn der zerebralen ALD entscheidend“, betont Weinhofer. Zeit – und eine einfach anwendbare, verlässliche Früherkennungsmethode. Denn bisher ist die Diagnostik kompliziert und belastend.
Schwierige und belastende Diagnose
In manchen Ländern wie den USA oder Niederlanden gibt es ein Screening für Neugeborene. Die Genetikerin Weinhofer würde sich tendenziell dafür aussprechen – benennt aber auch die Nachteile: Alle X-ALD-Diagnostizierten werden früher oder später erkranken (eine Heilung gibt es nicht) – aber „nur“ die Hälfte wird die zerebrale Form entwickeln. Für die Familien bedeutet die Diagnose aber Jahre der Angst und Unsicherheit. Ab sechs Jahren erhalten die diagnostizierten Buben dann halbjährlich eine Magnetresonanztomografie (MRT), die zeigen soll, ob die Blut-Hirn-Schranke bereits durchlässig ist und sich die weiße Hirnsubstanz entzündet.
Auch diese häufigen MRTs sind problematisch: „Kleine Kinder müssen dafür oft sediert werden“, zählt Weinhofer auf. „Sie bekommen Gadolinium verabreicht, ein Kontrastmittel, das sich im Gehirn anreichern kann – mit nicht bekannten Langzeitfolgen.“ Zudem entwickeln sich die Schäden manchmal untypisch, der MRT-Scan ist schwerer einschätzbar. „Da kann das Zeitfenster, in dem eine Transplantation Sinn macht, schon fast geschlossen sein.“
Lage und Ausmaß der Läsionen im Gehirn werden nach dem sogenannten Loes-Score mit bis zu 34 Punkten beurteilt. Transplantiert wird aber nur bis zu einem Score unter 9, danach ist die Zerstörung zu weit fortgeschritten. Für Angehörige kann dieser Befund schwer zu verstehen sein, da die Kinder zu dem Zeitpunkt oft noch relativ gesund erscheinen.
Klinisches Projekt sucht nach frühen Markern
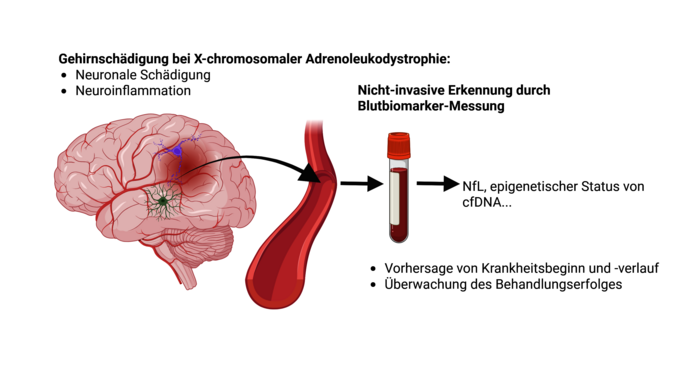
In dem vom Wissenschaftsfonds FWF geförderten klinischen Projekt „Blutmarker zur Bestimmung von Beginn und Verlauf der X-ALD“ (2020–2025) will Weinhofer einen weniger invasiven Bluttest entwickeln. Im Moment sind zwei Kandidaten vielversprechend: Zum einen ein Protein namens Neurofilament Light Chain (NfL), das bei allen Formen von neuronalen Schäden freigesetzt wird (etwa bei MS oder Alzheimer). Bei X-ALD steigt es auf extrem hohe Werte, sobald sich die Nerven entzünden.
„Wir konnten erstmals zeigen, dass NfL schon dann stark erhöht ist, wenn am MRT erst kleine Läsionen zu sehen sind, die Blut-Hirn-Schranke aber noch in Ordnung ist“, so Weinhofer. Bei Buben, bei denen die Entzündung gerade beginnt, ist der NfL-Wert signifikant höher als bei X-ALD-Patienten, die keine Hirnentzündung entwickeln. „NfL könnte also ein früher Marker für den Beginn der zerebralen ALD sein.“ Weinhofer will auch herausfinden, ab welchem NfL-Wert eine Rückenmarktransplantation noch sinnvoll ist. „Sobald wir hier genug Daten haben, könnten Eltern fundiertere Entscheidungen treffen – und wir könnten den wenig genauen Loes-Score ergänzen.“
App soll kritische Entzündungswerte ermitteln
Ihr Ziel ist eine App zum Monitoring von Kindern mit X-ALD. „Dort könnten Fachleute die NfL-Werte der Kinder eintragen, die würden mit den Daten einer Kontrollgruppe von gesunden Kindern verglichen, und wir bekämen einen Score, der zeigt, dass eine Neuroinflammation beginnt.“
Die X-ALD-Forschung erhielte damit auch wertvolle Daten, um den Zeitpunkt des Ausbruchs der zerebralen ALD per NfL genauer einzugrenzen. „Wir bekommen zwar Blutproben aus X-ALD-Zentren in aller Welt geschickt, aber die Fallzahlen sind insgesamt so niedrig, dass es ewig dauert, bis wir belastbare Werte haben. Das ist ein typisches Problem bei der Forschung über seltene Krankheiten.“
DNA-Spuren abgestorbener Zellen im Blut
Ein zweiter interessanter Marker, zu dem Weinhofers Lab forscht, sind DNA-Spuren abgestorbener Zellen, die ins Blut freigesetzt werden. „Jeder Zelltyp hat ein ganz bestimmtes Muster. Finde ich diese Spuren im Blut, weiß ich, dass dieser Zelltyp abstirbt – bei der zerebralen ALD zum Beispiel Immunzellen im Gehirn.“ Weil in jedem Organismus ununterbrochen Zellen sterben, ist es „eine Suche nach der Nadel im Heuhaufen“. Weinhofer arbeitet hier mit einem hochspezialisierten Bioinformatik-Labor in Israel zusammen, das die zellfreie DNA (cfDNA) aufspürt. „Damit könnten wir den Beginn der CALD eventuell noch viel früher entdecken als mit NfL“, freut sich Weinhofer über erste gute Ergebnisse. „In einem Folgeprojekt möchte ich diese Ergebnisse mit größeren Patientenzahlen bestätigen. Wenn das gelingt, könnten wir einen Bluttest-Kit zur Früherkennung zusammenstellen, der für die Betroffenen, aber auch die behandelnden Kliniken, wirklich eine enorme Erleichterung wäre.“
Zur Person
Isabelle Weinhofer studierte Biologie und Genetik und ist Assistenzprofessorin am Zentrum für Hirnforschung der Medizinischen Universität Wien, wo sie in der Abteilung für Pathobiologie des Nervensystems eine Arbeitsgruppe leitet. Ihr Forschungsfokus liegt auf Veränderungen im Fettstoffwechsel, die zu einer Neuroinflammation führen, und zu den Auswirkungen solcher Entzündungen auf verschiedene Gehirnzelltypen. Ihre früheren Arbeiten zur Rolle der Makrophagen haben wesentlich zum Verständnis der Stammzelltransplantation als lebensrettende Maßnahme bei X-ALD beigetragen. Von 2008 bis 2010 war sie mit einem vom Wissenschaftsfonds FWF finanzierten Erwin-Schrödinger-Stipendium als Postdoc an der ETH Zürich. Eine FWF-ESPRIT-Stelle (ehemals Hertha Firnberg) ermöglichte ihr die Rückkehr ans Zentrum für Hirnforschung in Wien.
Das Projekt
Die Früherkennung und Beurteilung des Fortschritts der seltenen neurodegenerativen Erkrankung X-chromosomale Adrenoleukodystrophie (X-ALD) ist aufwendig und für die Betroffenen und ihre Familien sehr belastend. Im klinischen Forschungsprojekt „Blutmarker zur Bestimmung von Beginn und Verlauf der X-ALD“ werden Blutbiomarker identifiziert und getestet, die die Diagnose entscheidend verbessern könnten. Die Förderung durch den FWF beträgt rund 383.000 Euro. Das Projekt läuft noch bis Ende September 2025, ein Folgeprojekt ist in Einreichung.
Publikationen
Im Rahmen des Projekts sind neun Publikationen erschienen und zwei weitere eingereicht. Die wichtigsten sind:
Isabelle Weinhofer et al.: Neurofilament light chain as a potential biomarker for monitoring neurodegeneration in X-linked adrenoleukodystrophy, in: Nature Communications 2021
Isabelle Weinhofer et al.: Biomarker-based risk prediction for the onset of neuroinflammation in X-linked adrenoleukodystrophy, in: EBioMedicine 2023





