Wie Viren Barrieren überwinden

Doris Wilflingseder beschäftigt sich seit Jahrzehnten mit dem komplexen Kampf von Organismen gegen Eindringlinge wie Viren. Wenn Erreger den Körper durch die Haut oder Schleimhaut angreifen, kommt es zu einem dynamischen Prozess durch die Immunantwort des Wirts. Was genau dabei passiert, ist immer noch nicht ganz verstanden. Wilflingseder fokussierte ihre Forschung auf HIV und wollte verstehen, wie das Virus in den menschlichen Körper gelangt. Dabei hat sie in einem vom Wissenschaftsfonds FWF geförderten Projekt festgestellt, dass das Virus von körpereigenen Proteinen ummantelt wird. Diese verändern die Oberfläche des Erregers und erleichtern damit den Eintritt in dendritische Zellen – die eine wichtige Abwehrfunktion im Immunsystem haben.
„Im Labor haben wir HIV sowohl in Serum als auch in Samenflüssigkeit inkubiert und gesehen, dass das Virus tatsächlich eine Protein-Corona erhält, weil es mit den Proteinen in diesen Flüssigkeiten interagiert. Dabei handelte es sich überwiegend um Komplementproteine“, erklärt Wilflingseder, die seit gut einem Jahr am neu gegründeten Ignaz Semmelweis Institut in Wien forscht – einem interuniversitären Science-Hub mit Fokus auf Infektionskrankheiten und Pandemien.
Eine zusätzliche Rolle spielen HIV-spezifische Antikörper, die in späteren Infektionsphasen entstehen. „Darum testen wir auch Viren, die mit solchen Antikörpern bedeckt sind.“ Das Team analysierte, wie sich die zellulären Prozesse unterscheiden, je nachdem, ob eine Zelle ein nacktes Virus, ein komplementumgebenes Virus oder ein antikörperumgebenes Virus aufnimmt.
Die Ergebnisse zeigen deutliche Unterschiede. „Wir haben gesehen, dass komplementumgebene Viren eine starke Immunantwort über dendritische Zellen auslösen“, so Wilflingseder. Dagegen reagieren dendritische Zellen, die mit nackten HIV-Partikeln beladen werden, mit einer schwachen Immunantwort, da das Virus in diesem Fall von Restriktionsfaktoren in der Zelle blockiert wird. Kommt die Zelle hingegen mit einem Virus in Kontakt, das durch eine „Proteinschicht“ geschützt ist, kann dieses Mechanismen nutzen, um die Restriktionsfaktoren zu umgehen.
Dieses Muster entspricht dem, was man in der akuten Phase einer HIV-Infektion beobachtet. „Zu Beginn versucht das Komplementsystem, das Virus in Schach zu halten, bevor später HIV-spezifische Antikörper hinzukommen.“
One Health – One Planet
Infektionskrankheiten können schwere Erkrankungen auslösen. Jährlich verursachen sie weltweit Millionen Todesfälle.
Durch Klimawandel, enge Mensch-Tier-Kontakte, knappen Lebensraum und globale Vernetzung steigt das Risiko für neue Ausbrüche und Pandemien.
Grundlagenforschung ist die Voraussetzung für ein besseres Verständnis von ansteckenden Krankheiten. Das Wissen über Erreger und Immunantworten ist die Basis für Prävention, Impfstoffe und Medikamente.
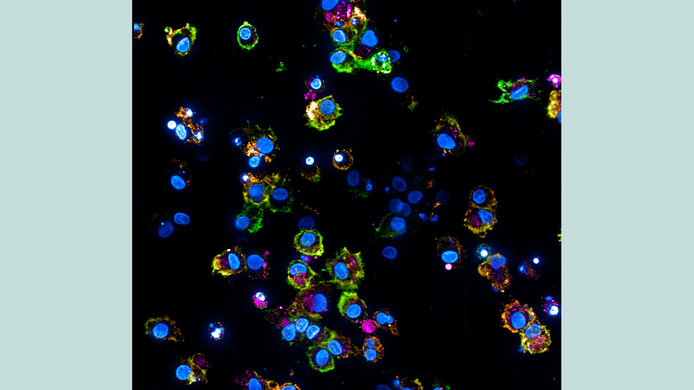
Von HIV zu SARS-CoV-2
Als Covid-19 die Welt erreichte, stellte Wilflingseder ihre Forschung um und griff dabei auf Erfahrungen aus den HIV-Projekten zurück. „Wir haben unsere Fragestellungen bezüglich HIV auch auf SARS-CoV-2 übertragen.“ Im Zentrum ihres Ansatzes steht die Schleimhautbarriere, an der dendritische Zellen zu den ersten gehören, die Kontakt mit eindringenden Viren haben. „Die Idee ist, bestimmte Rezeptoren gezielt anzusprechen und für zukünftige Impf- oder Therapiestrategien zu nutzen“, sagt Wilflingseder.
Zellmodelle statt Tierversuche
Schon vor Jahren begann Wilflingseder mit der Entwicklung spezialisierter Zellmodelle, damals noch an der Medizinischen Universität Innsbruck. Für HIV verfügte ihr Team über Modelle mit dendritischen Zellen und T-Zellen, später folgten Schleimhautmodelle. In Innsbruck kam ein weiterer Schwerpunkt hinzu. „Die Direktorin unseres Instituts, Cornelia Lass-Flörl, war an Pilzinfektionen in der Lunge interessiert und fragte mich, ob ich ein Lungenmodell entwickeln möchte.“ So entstand ein Luft-Flüssig-Phasen-Modell, das Schleim produziert und Flimmerhärchen enthält. „Wir haben dieses Modell etabliert, optimiert und standardisiert“, erzählt Wilflingseder. In dieses System integrierte die Gruppe Immunzellen wie dendritische Zellen oder Makrophagen, um ein möglichst realistisches Modell der Atemwege zu entwickeln.
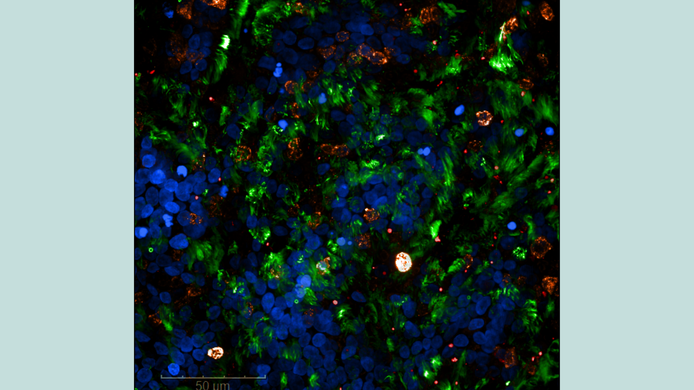
In Bezug auf SARS-CoV-2 erwies sich diese Vorarbeit als großer Vorteil. Mit Unterstützung der Inneren Medizin in Innsbruck erhielt das Team bereits im März 2020 erste Virenproben von Patient:innen. „Im Labor haben wir untersucht, wie die Viren mit diesen hochentwickelten respiratorischen Barrieren interagieren“, sagt Wilflingseder. Dabei zeigte sich eine Überproduktion von Schleim, ein Befund, der auch bei schwer erkrankten Covid-19-Patient:innen beschrieben wurde.
Zudem wurde geprüft, ob Epithelzellen, die die erste physikalische, chemische und mechanische Barriere unseres Körpers bilden, ohne eine Immunzelle entzündliche Reaktionen auslösen können. „Wir haben untersucht, ob auch die Epithelzellen Komplementfaktoren produzieren, und tatsächlich festgestellt, dass das der Fall ist. Durch die Komplementaktivierung entstehen starke Entzündungen“, erklärt Wilflingseder. Auch diese Ergebnisse entsprachen klinischen Beobachtungen schwerer Covid-19-Verläufe, wo es zu einer Überproduktion von Komplementfaktoren kam. Therapeutische Versuche in der Zellkultur zeigten, dass sich die überschießende Immunreaktion durch Blockieren des Komplementsystems stoppen ließ.
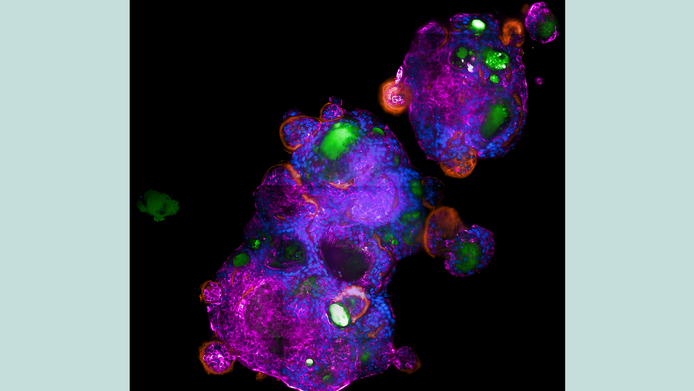
Organoide und das besondere Immunsystem der Fledermaus
Parallel dazu begann das Team um die Gründungsprofessorin für Infektiologie am Ignaz Semmelweis Institut in Wien mit der Entwicklung von Organoidmodellen verschiedener Tierarten. „In Innsbruck haben wir ausschließlich im Humansystem gearbeitet. Jetzt entwickeln wir Modelle unterschiedlicher Spezies, die für zoonotische Viren relevant sind (Anm.: Viren, die von Tieren auf den Menschen übertragen werden). In den nächsten Jahren wollen wir auch untersuchen, was geschieht, wenn ein Virus von einer Spezies auf eine andere übergeht.“ Was in der Forschung auch als Auslöser der Coronapandemie vermutet wird. Doch Wilflingseder will sich nicht auf ein bestimmtes Virus festlegen, denn auch Pilzinfektionen oder Co-Infektionen interessieren sie, da gerade bei HIV weitere Infektionen oft gravierende Folgen haben.
Fledermäuse stehen besonders im Fokus der Forschenden in Wien. „Fledermäuse sind generell faszinierend, weil sie kaum Virusinfektionen entwickeln“, sagt Wilflingseder. Ihr Stoffwechsel unterscheidet sich stark vom menschlichen: extreme Temperaturschwankungen, hoher Energieverbrauch beim Fliegen und ein stark reduzierter Stoffwechsel in Ruhephasen. Besonders spannend findet sie das Komplementsystem. „Es ist ein sehr altes, konserviertes System, und Komplementproteine wurden bereits in Seeigeln identifiziert.“ Fledermäuse besitzen, wie Studien belegen, im Serum deutlich höhere Komplementkonzentrationen als Menschen. Diese Besonderheit möchte die Gruppe genauer untersuchen.
Mund- und Nasensprays bremsen Viren
Ein weiteres Projekt widmet sich der Frage, ob einfache Maßnahmen wie antivirale Sprays Viren bremsen können. Zu Beginn der Pandemie untersuchte das Team die Wirkung verschiedener Mund- und Nasensprays und testete sie auf einem Luft-Flüssig-Phase-Modell von Epithelzellen der Bronchien. Sie versprühten die Präparate aus definierter Distanz, infizierten das Gewebe anschließend und analysierten es über mehrere Tage. „Wir haben gesehen, dass bis zu zwei Stunden nach der Infektion ein guter Schutzeffekt bestand.“ Rezeptfrei erhältliche Sprays aus der Apotheke können laut Beipackzettel sechsmal täglich eingesetzt werden, also etwa alle zwei Stunden.
Neue Wege in der Medikamentenentwicklung
„Mir ist der Ersatz von Tierversuchen extrem wichtig“, betont Wilflingseder. Hinsichtlich der Medikamentenentwicklung hat sich in den USA dazu bereits einiges geändert. Über Jahrzehnte mussten Medikamente zwingend in zwei sehr unterschiedlichen Tierarten getestet werden. Die FDA hat dieses System nun modernisiert: Heute darf die Methode verwendet werden, die am effektivsten ist. „Man kann Zellkultursysteme nutzen, wenn sie prädiktiver sind, oder sie mit In-silico-Modellen kombinieren.“ Die Entwicklung induzierter pluripotenter Stammzellen und ausgefeilter Organoide hat enorme Fortschritte bewirkt. Viele Modelle ermöglichen inzwischen bessere Prognosen als Tierversuche.
Auch die europäische Regulatorik bewegt sich in diese Richtung. Die Europäische Arzneimittel-Agentur (EMA) und EU-Förderprogramme unterstützen zunehmend „New Approach Methods“ und nicht-tierische Testsysteme. Darin sieht Doris Wilflingseder großes Potenzial. Durch konstruktive Zusammenarbeit, die auch bei den Austrian 3R Days 2026 wieder gelebt wird, können Forschende einander wechselseitig Impulse geben und gemeinsam zur Reduktion von Tierversuchen beitragen. „Dass man Tierversuche von heute auf morgen ersetzt, wird nicht möglich sein, aber man kann sehr viel zu ihrer Reduktion beitragen“, ist Wilflingseder überzeugt. Für ihre Zellkulturmodelle wurde sie 2021 mit dem Staatspreis zur Förderung von Ersatzmethoden zum Tierversuch ausgezeichnet.
Zur Person
Doris Wilflingseder ist eine österreichische Immunologin und Infektionsbiologin. Sie forschte an der Medizinischen Universität Innsbruck zu dendritischen Zellen und HIV-1, und unter anderem am University College London. 2024 übernahm sie die Gründungsprofessur für Infektiologie an der Veterinärmedizinischen Universität Wien am neu gegründeten, interuniversitären Ignaz Semmelweis Institut.
Im Zentrum ihrer Arbeiten stehen immunkompetente 3D-Barrieremodelle zur Untersuchung des Eindringens und der Verarbeitung von Erregern. Sie gilt als eine führende Stimme für tierversuchsfreie Forschung, wofür sie 2021 mit dem österreichischen Staatspreis für Ersatzmethoden zum Tierversuch ausgezeichnet wurde. Wilflingseder engagiert sich zudem in der RepRefRed Society sowie im österreichischen 3R-Zentrum zur Förderung alternativer Biomodelle.





