Alzheimer verstehen: Wie Eiweiße im Gehirn wandern

Die Alzheimerdemenz (AD) ist die häufigste neurodegenerative Erkrankung: Das Absterben von Nervenzellen – genauer, des Botenstoffes Acetylcholin – führt mit der Zeit zum Verlust des Gedächtnisses. Fast alle Alzheimer-Fälle (99 Prozent) sind „erworben“, haben also keine erbliche Komponente: Etwa ab 60 Jahren erhöht sich die Krankheitswahrscheinlichkeit durch das Altern, das damit der größte Risikofaktor ist.
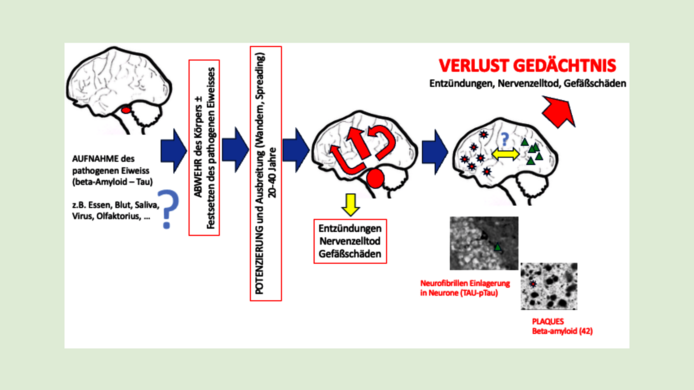
Typisch für die Alzheimererkrankung sind Veränderungen bestimmter Eiweiße im Gehirn: das β-Amyloid und das Tau-Eiweiß. Manche Formen von β-Amyloid (vor allem das β-Amyloid 42) neigen zum Verklumpen und bilden außerhalb der Nervenzellen die gefürchteten Plaques. Diese verändern die Signalübertragung der Synapsen und können Entzündungen triggern. Neue Therapeutika (Impfungen) können das β-Amyloid zwar reduzieren und den kognitiven Abbau verlangsamen, allerdings auch starke Nebenwirkungen auslösen.
Das zweite Eiweiß, Tau, ist ein Strukturprotein. Es stabilisiert bestimmte Bauteile im Inneren von Nervenzellen. Bei Alzheimer verändert es sich: Es hyperphosphoryliert – das heißt, es bekommt zu viele Phosphatgruppen – und verklumpt im Inneren der Zelle.
Alzheimer besser verstehen
Eine der großen Fragen in der Demenzforschung lautet, wie die Ablagerungen (Plaques) entstehen und wie sie sich ausbreiten. Christian Humpel von der Medizinischen Universität Innsbruck hat eine Methode entwickelt, um die Verbreitung der Eiweiße zu beobachten.
Die Spreading-Hypothese testen
Eine Reihe von Hypothesen kreist um die Fragen, warum es zu den Ablagerungen kommt und was ihre Ausbreitung im Gehirn vorantreibt. Diesen Fragen hat auch der Alzheimer-Experte Christian Humpel von der Medizinischen Universität Innsbruck seine Forscherkarriere gewidmet. In dem Ende 2024 abgeschlossenen Projekt „Ausbreitung der Alzheimer-Pathologie in Gehirnschnitten“ verwendete Humpel eine von ihm über fast drei Jahrzehnte verfeinerte Methode, um sich die Verbreitung der Eiweiße näher anzusehen: Gehirnschnitte von Mäusen.
„Wir wissen, dass die ersten Eiweißveränderungen schon Jahrzehnte vor den ersten Symptomen ab einem Alter von 30 Jahren auftreten können“, erklärt Humpel. Die Spreading- oder Ausbreitungsthese besagt, dass sich der Fehler – von einem Gehirnareal ausgehend – exponentiell in benachbarte Gehirnregionen ausbreitet. Zuerst geht das sehr langsam – und tatsächlich zeigen die Erkrankten über viele Jahrzehnte hinweg keinerlei Symptome. Ab etwa 60 oder 70 Jahren beschleunigt sich die Ausbreitung dann aber so stark, dass das gesamte Gehirn betroffen sein kann. „Wir können uns das wie eine Lawine vorstellen“, so Humpel. Erst wenn ein Großteil der Nervenzellen abgestorben ist und massive Verklumpungen im Gehirn zu finden sind, setzt der für Alzheimer typische und gefürchtete Gedächtnisverlust ein.
„Wir wissen, dass Eiweißveränderungen Jahrzehnte vor den ersten Symptomen ab einem Alter von 30 Jahren auftreten können.“
Mutierte Eiweiße wandern ins Gehirn
Eine mittlerweile als wahrscheinlich geltende, aber noch nicht abschließend bewiesene Theorie der Alzheimerforschung ist, dass sich die krankhaften Eiweiße ähnlich verhalten wie Prionen, die Auslöser zum Beispiel von Creutzfeldt-Jakob, dem „Rinderwahn“ oder der Kuru-Krankheit. Kuru ist in Papua-Neuguinea bei Völkern aufgetreten, die rituell die Gehirne von Verstorbenen verzehrt haben.
„Der Prionenhypothese zufolge gelangt ein mutiertes, pathogenes Eiweiß irgendwie ins Gehirn – das könnte vielleicht durchs Essen sein – und verändert ein gesundes Eiweiß so, dass es selbst pathogen wird“, sagt Humpel. Kaskadenartig würden dann weitere gesunde Eiweiße angesteckt. Immunzellen im Gehirn – die Mikroglia – arbeiten zwar ständig daran, Fehler zu korrigieren, doch im Alter ermüden sie.
Staatspreis für Gehirnschnitte statt Tierversuche
Humpel verwendete dreidimensionale „organotypische Gehirnschnitte“, um zu untersuchen, ob die Ausbreitung entlang bestimmter Bahnen erfolgt – eine Methode, für die er 2000 den Staatspreis für Ersatzmethoden zum Tierversuch bekommen hat. Für die Gehirnschnitte werden acht bis zehn Tage alten Mäusen die Gehirne entnommen („Organentnahme“) und mit einem Vibratom – „ähnlich wie mit einer Wurstschneidemaschine“ – in 150 Mikrometer dünne „slices“, also Scheiben, geschnitten. Die Gehirne stammten von gesunden Tieren sowie von eigens für die Alzheimerforschung gezüchteten, genetisch veränderten Mäusen, die selbst Plaques ausbilden.
Organotypisch bedeutet, dass die ursprüngliche Zellarchitektur und das Zusammenspiel der Zellen ähnlich wie im lebenden Organ erhalten bleiben: mit Nervenzellen, Gliazellen, Blutgefäßen. „Das hat den Vorteil, dass wir nicht nur einzelne Zelltypen studieren, sondern das Zusammenspiel in einer bestehenden Gehirnarchitektur sehen.“
Als nächster Schritt werden zwei Gehirnschnitte auf spezielle Membranen aufgetragen, nebeneinandergelegt und kultiviert (normalerweise etwa zwei bis vier Wochen lang). Auf den oberen der zwei Schnitte trägt der Forscher krankhaft verändertes β-Amyloid oder Tau-Protein auf. Die Eiweiße werden in ein winziges Kollagenkügelchen eingebracht, welches das Eiweiß langsam freisetzt, sobald sich das Kollagen aufgelöst hat. Anschließend beobachtet der Forscher, ob und wie sich das Eiweiß in den zweiten Gehirnschnitt ausbreitet. In einer dritten Versuchsreihe hat Humpel weiters α-Synuclein getestet und gezeigt, dass die Spreading-Hypothese auch für die Ausbreitung von Parkinson relevant sein kann.
Wandernde Eiweiße und Abwehrreaktionen
Die Versuche stützen die Ausbreitungstheorie: β-Amyloid breitet sich in das benachbarte Gewebe aus, Tau wandert entlang von Nervenzellverbindungen vom oberen zum unteren Schnitt. Nun müsste weitere Forschung klären, ob sich Erkenntnisse, die mit jungen Mäusegehirnen gewonnen wurden, auch auf den Menschen übertragen lassen. Für weitere Versuche könnten Gehirnschnitte von erwachsenen Mäusen oder Schnitte von verstorbenen Menschen getestet werden.
„Was wir bei den Versuchen ebenfalls gesehen haben, ist, dass die Mikroglia sich gegen das schadhafte Eiweiß wehren: Sie fressen es auf“, fährt Humpel fort. Umgekehrt erfolgte die lawinenartige Ausbreitung der Eiweiße in den Gehirnen der Alzheimer-Mäuse, die bereits Plaques ausgebildet hatten, deutlich schneller. „Es dürfte also individuelle Vorbedingungen geben, die Alzheimer begünstigen – oder auch behindern.“
Inzwischen ist beispielsweise bekannt, dass ein aktiver Lebensstil mit einem geringeren Risiko für Alzheimerdemenz assoziiert ist: Viel Bewegung und gesunde Ernährung könnten ebenso zur Prävention beitragen wie „Hirntraining“ durch unterschiedliche Aktivitäten, lebenslanges Lernen und soziale Kontakte.
„Ich sage meinen Studierenden immer, dass wir die krankheitsverhindernden Vorbedingungen selbst schaffen können: mit allem, was die Gefäße im Gehirn in Schuss hält.“ Doch Humpel wünscht sich auch mehr Grundlagenforschung. „Die Gesellschaft altert, die Zahl der Alzheimer-Erkrankten wird in den nächsten Jahren massiv steigen“, sagt er. „Würden wir die Krankheit endlich im Detail verstehen, könnten wir sie vielleicht viel früher verhindern. Das würde Millionen Menschen helfen und enorme Kosten sparen.“
Zur Person
Christian Humpel studierte Biologie in Innsbruck, wo er sich – nach einem Schrödinger-Stipendium am Karolinska-Institut in Schweden – im Jahr 1996 habilitierte. Seit 1998 leitet der Neurobiologe das Labor für Experimentelle Psychiatrie an der Universitätsklinik für Psychiatrie der Medizinischen Universität Innsbruck, wo er den Forschungsschwerpunkt Alzheimer etablierte. 2019 wurde er auf eine Professur berufen.
Ein weiterer Forschungsschwerpunkt von Christian Humpel ist die Entwicklung neuer Biomarker im Liquor, im Blut und im Speichel für die Diagnose der Alzheimerdemenz. Für seine Forschungen erhielt er den Otto-Loewi-Preis der Österreichischen Gesellschaft für Neurowissenschaften und kürzlich den Dr. Johannes und Hertha Tuba Preis für sein Lebenswerk. Das Projekt „Ausbreitung der Alzheimer-Pathologie in Gehirnschnitten“ lief von 2020 bis Ende 2024 und wurde vom Wissenschaftsfonds FWF mit 393.000 Euro gefördert.
Die Spreading-Hypothese
Die schwere neurodegenerative Alzheimerdemenz bildet Eiweißablagerungen im Gehirn und in Nervenzellen. Bisher ist unklar, warum und wie diese Ablagerungen entstehen. Die Ausbreitungs- bzw. Spreading-Hypothese besagt, dass die Eiweiße sich verändern und von einer Gehirnregion zur nächsten verbreiten. Ziel des FWF-Projekts war es, diese Hypothese anhand eines dreidimensionalen organotypischen Gehirnschnitts der Maus zu studieren. Die Ausbreitung konnte bestätigt werden.
Publikationen
Die drei wichtigsten der insgesamt 16 projektrelevanten Publikationen:
Spreading of Aggregated α-Synuclein in Sagittal Organotypic Mouse Brain Slices, in: Biomolecules 2022
Spreading of P301S Aggregated Tau Investigated in Organotypic Mouse Brain Slice Cultures, in: Biomolecules 2022
Spreading of Beta-Amyloid in Organotypic Mouse Brain Slices and Microglial Elimination and Effects on Cholinergic Neurons, in: Biomolecules 2021





