Pflanzen mit Strom füttern

Die Bedeutung von Ammoniak (NH3) ist in der Öffentlichkeit kein oft diskutiertes Thema, doch ist diese Substanz eine der meistproduzierten und wichtigsten Chemikalien für eine Vielzahl von Anwendungen. Weltweit werden fast 150 Millionen Tonnen Ammoniak pro Jahr hergestellt. Diese finden Verwendung als Kältemittel oder bei der Herstellung von Kunststoffen – der überwiegende Teil wird allerdings für die Produktion von Kunstdünger benutzt. Pflanzen brauchen den Stickstoff darin für Wachstum und Photosynthese. Deshalb ist Ammoniak aus unserer modernen Gesellschaft nicht mehr wegzudenken. Zwar kommt einer der Bestandteile – Stickstoff – als N2-Molekül in unserer Atmosphäre in großer Menge vor, doch benötigt die Ammoniaksynthese auch noch Wasserstoff (H2) als Ausgangsstoff. Für die Produktion von Wasserstoff werden aktuell hauptsächlich fossile Rohstoffe eingesetzt. Zusätzlich werden für die energieintensive Ammoniakproduktion aus N2 und H2 bisher ebenfalls fossile Energieträger eingesetzt. Das Team um Alexander Opitz an der Technischen Universität Wien forscht in seinem Projekt „Pflanzen mit Strom füttern“ an einer nachhaltigen Alternative dazu.
„Wir haben dieses Projekt gestartet, weil wir mit unserer Expertise in Elektrochemie eine neue Form der Ammoniakerzeugung entwickeln möchten, die erneuerbare Energie und Rohstoffe nutzt“, erklärt Alexander Opitz. „Eine der größten Schwierigkeiten dabei ist, wie man es schaffen kann, die enorm stabilen Stickstoffmoleküle in der Atmosphäre aufzubrechen und mit Wasserstoffatomen zu verbinden, um Ammoniak zu erzeugen.“
Das Forschungsprojekt „Pflanzen mit Strom füttern“ (2021–2024), wird im Rahmen des 1000-Ideen-Programms für besonders innovative Forschung vom FWF finanziert.
Das Ziel ist, ein neues elektrochemisches Verfahren der Ammoniakerzeugung auf Basis nachhaltiger Energie und Rohstoffe zu entwickeln.
Ammoniak (NH3) besteht aus einem Stickstoffatom, an das drei Wasserstoffatome gebunden sind. Stickstoffatome verbinden sich gerne mit einem anderen Stickstoffatom und bilden als N2 ein sehr stabiles Molekül. Anfang des 20. Jahrhunderts wurde das Haber-Bosch-Verfahren entwickelt, das mit mehreren Hundert Atmosphären Druck und mit mehreren Hundert Grad Celsius die Stickstoffmoleküle aufbricht, um Ammoniak herzustellen. Dieser chemische Prozess ist so energieaufwendig, dass allein die Produktion von Ammoniak für 1,4 Prozent der weltweiten Kohlenstoffdioxidemissionen und etwa 1 Prozent des globalen Energieverbrauchs verantwortlich ist, wodurch hier ein enormes Einsparungspotenzial besteht. Da sich dieses Verfahren erst in großem Maßstab wirtschaftlich rentiert, konzentriert sich die weltweite Ammoniakproduktion auch auf nur etwa 100 industrielle Anlagen. Hier setzt die Forschung von Alexander Opitz an.
Druck durch Spannung
Zusammen mit dem Postdoc Maximilian Weiss, der Doktorandin Melanie Anstiss und dem Diplomanden Christian Wimmer forscht Opitz an einem alternativen Weg, um Ammoniak herzustellen. „Anstatt mit viel Energieaufwand Wasserstoffgas mit Hunderten Bar Druck zu erzeugen, damit es sich an den Stickstoff binden kann, nutzen wir die Prozesse an den Elektroden elektrochemischer Zellen – ähnlich wie bei der Elektrolyse“, erklärt Opitz.
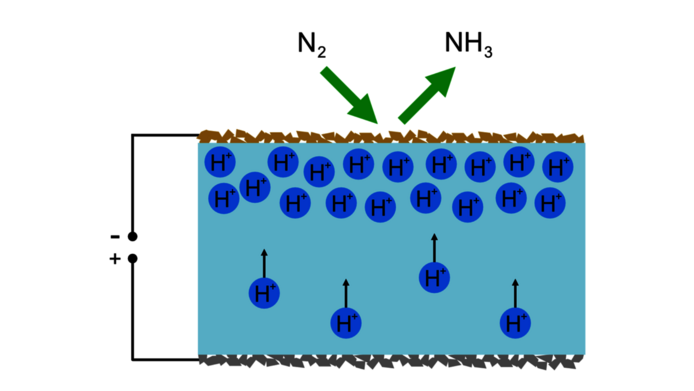
Bei der Elektrolyse erzwingt elektrischer Strom eine chemische Reaktion an einer Elektrode. „In unserem Versuchsaufbau nutzen wir ein besonderes keramisches Elektrodenmaterial, das wir selbst herstellen. Im Gegensatz zu vielen anderen Materialien kann es sowohl negativ geladene Elektronen als auch positiv geladene Protonen – die Kerne von Wasserstoffatomen – leiten. In Kombination mit einem protonenleitenden Elektrolyten zwischen den Elektroden können wir Wasserstoff durch die elektrochemische Zelle pumpen und dessen effektiven Druck an der Elektrode mit der angelegten elektrischen Spannung beeinflussen.“
Im Experiment bringt die Forschungsgruppe zuerst Wasserstoffgas zu einer Seite des keramischen Elektrolyten. An der dort befindlichen Elektrode verlieren die Wasserstoffatome ihr einziges Elektron und übrig bleibt nur der Atomkern – ein einzelnes Proton, das sich innerhalb des Elektrolyten bewegen kann. Die angelegte elektrische Spannung zwingt die positiv geladenen Protonen dann auf die andere Seite des Elektrolyten, wo sich die zweite Elektrode befindet. Diese zweite Elektrode ist aus dem besonderen keramischen Material gefertigt und dort entsteht der hohe Wasserstoffdruck, der für die Produktion von Ammoniak benötigt wird. „Das ist der Trick in unserem Projekt“, erklärt Opitz. „Wir können Wasserstoff unter hohen Druck setzen, indem wir einfach elektrische Spannung anlegen. Die Energie dafür kann dann auch aus erneuerbaren Quellen kommen.“
Auf der Oberfläche des Kathodenmaterials ist zudem noch ein Katalysator angebracht, ein speziell ausgewähltes Material, das hilft, die stabilen Stickstoffmoleküle aus der Luft aufzubrechen und mit Wasserstoff zu verbinden.
Nachhaltige Rohstoffe und Dezentralisierung
„Es gab viele Probleme zu lösen und wir haben auch noch viel Arbeit vor uns“, erklärt Opitz. „Zum Beispiel mussten wir zuerst einmal eine effektive Methode finden, um die Konzentration des Wasserstoffs in unseren keramischen Materialien im Labor einfach messen zu können. Das haben wir dank einer erfolgreichen Kooperation mit Kolleg:innen der analytischen Chemie an der TU Wien geschafft.“
Als einen der nächsten Schritte arbeiten die Forschenden an der Auswahl des besten Katalysators und sie möchten auch eine nachhaltige Quelle für Wasserstoff in ihr Verfahren einbauen. „Bisher wird ein Großteil des Wasserstoffs aus fossilem Erdgas gewonnen. Wir möchten unser Verfahren erweitern, um den Wasserstoff, den wir dann durch unsere elektrochemische Zelle pumpen, direkt aus Wasser zu erzeugen“, sagt Opitz.
Zwar wird die Forschung an der elektrochemischen Ammoniakproduktion noch einige Zeit andauern, doch Opitz und sein Team sind hoch motiviert und haben ihren Blick auch schon auf etwaige Anwendungsgebiete gerichtet. „Unser Zugang könnte auch andere chemische Reaktionen mit Wasserstoff auf nachhaltigere Beine stellen. Außerdem können wir damit eine dezentralisierte Ammoniakproduktion ermöglichen, denn unsere Technologie lässt sich relativ einfach größer und kleiner skalieren. Zum Beispiel könnten landwirtschaftliche Betriebe dann mit einer kleinen Anlage Ammoniak für ihren lokal benötigten Dünger selbst erzeugen. Damit könnten sie die Pflanzen auf ihren Feldern mit Stickstoff aus eigener Produktion füttern.“
Zur Person
Alexander Opitz leitet die Forschungsgruppe Elektrochemische Energieumwandlung an der TU Wien. In seiner Forschung widmete er sich vorrangig der In-situ-Charakterisierung von gemischt ionisch und elektronisch leitenden Materialien sowie der Untersuchung sogenannter Exsolution-Elektroden. Dieses Thema führte ihn 2017 als Gastwissenschaftler an das Massachusetts Institute of Technology (MIT). Alexander Opitz wurde im Jänner 2022 habilitiert und zum Associate Professor ernannt.





