Ein molekularer Jungbrunnen fürs Gehirn
Wenn wir in die Jahre kommen, bleibt auch das Gehirn nicht verschont: Neues zu lernen, fällt schwerer und das Gedächtnis hat gelegentlich Aussetzer. Nicht immer bleibt es bei harmlosen Symptomen. Altern ist ein Risikofaktor für neurodegenerative Krankheiten wie etwa Parkinson und Alzheimer, bei denen die Nervenzellen besonders schnell und in großer Zahl absterben. Wichtige Gehirnfunktionen gehen dabei unwiederbringlich verloren. Denn einmal abgestorbene Neuronen kann der Körper – im Unterschied etwa zu Hautzellen – nicht ersetzen.
Weltweit sind Forschende daher auf der Suche nach Interventionen, die die Gehirnalterung verlangsamen oder ihre Folgen abmildern. Doch der Weg dahin ist weit, weiß Frank Edenhofer, Leiter der Forschungsgruppe Genomik, Stammzellbiologie und Regenerative Medizin an der Universität Innsbruck: „Die molekularen Prozesse, die bei neuronaler Alterung eine Rolle spielen, liegen noch weitgehend im Dunkeln. Erst wenn wir diese besser verstehen, sind möglicherweise Therapien denkbar, die Alzheimer und Co. ursächlich entgegenwirken.“
Alterungsprozesse im „Mini-Gehirn“
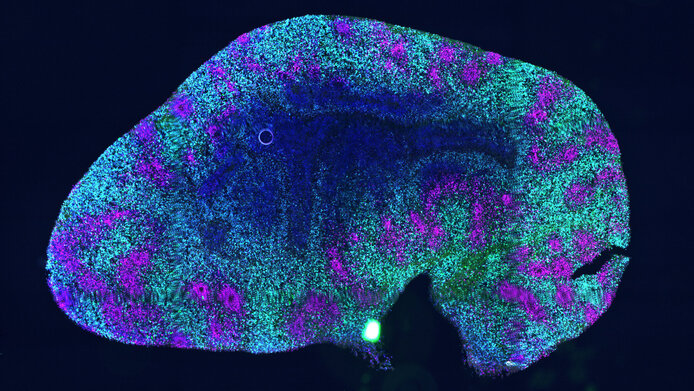
Auf dem Weg dahin ist dem Stammzellforscher und seinem Team ein wichtiger Erfolg geglückt: Der Gruppe gelang es, typische Alterungsprozesse in sogenannten Gehirn-Organoiden nachzuweisen. Das sind 3D-Miniaturgehirne, die dem Aufbau des menschlichen Denkorgans näherkommen als Mäusegehirne und 2D-Zellkulturen. Zum ersten Mal steht damit ein humanes Gewebemodell zur Verfügung, das es ermöglicht, dem Gehirn beim Altern zuzusehen. „Wir sehen typische degenerative Vorgänge: oxidative und andere altersbedingte Schäden an der DNA sowie verringerte mitochondriale Aktivität“, berichtet Edenhofer.
Bemerkenswert sei auch die „epigenetische Erosion“, so der Stammzellbiologe: „Epigenetische Marker geben Zellen ihre Identität. Wir haben gesehen, dass diese Markierungen graduell verloren gehen. Dadurch ‚vergessen‘ die betroffenen Neuronen, was sie sind, und hören auf zu funktionieren.“ Diese Beobachtung unterstreicht, wie wichtig epigenetische Veränderungen im Zusammenhang mit dem Altern sind.
Verjüngungskur für Nervenzellen
Lässt sich die Gehirnalterung hinauszögern oder gar umkehren? Einer Forschergruppe um den Stammzellforscher Frank Edenhofer an der Universität Innsbruck ist es gelungen, in Mini-Gehirnen aus menschlichem Gewebe Alterungsprozesse zu beobachten. Als nächstes wollen die Wissenschaftler:innen alte Neuronen in junge umprogrammieren.
Kreativer Forschungsansatz belohnt
Das Forscherteam hat die vielversprechenden Ergebnisse vor Kurzem zur Publikation eingereicht – ein erster Lohn für zahlreiche Herausforderungen: „Die Organoide zum Altern zu bringen, war schwierig. Da sie aus Stammzellen erzeugt werden, befinden sie sich in einem ‚jungen‘ Entwicklungsprogramm“, erklärt Frank Edenhofer. „Daher mussten wir die Zellen zur Expression eines Proteins namens Progerin zwingen, welches das Altern induziert. Dafür hat es viele Anläufe gebraucht.“ Im Menschen löst Progerin das Hutchinson-Gilford-Syndrom aus, das zu extrem frühzeitiger Alterung führt.
Die Mühen haben sich ausgezahlt: Einmal etabliert, ist das Organoid-Modell nun Ausgangspunkt für Folgestudien, die das Verständnis vom neuronalen Altern verbessern werden. So hofft das Team, neue Gene zu identifizieren, die dabei eine Rolle spielen. Hinweise darauf waren bereits im Profil der Genaktivitäten der Organoide zu sehen: „Wir sehen einige unerwartete Gene, die noch nicht im Kontext von Gehirnalterung beschrieben wurden“, sagt Edenhofer.
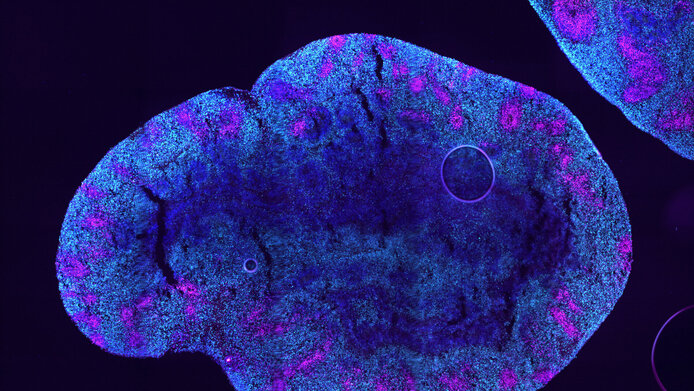
Ziel: eine Frischzellenkur fürs Gehirn
Auch ein brisantes Thema der Langlebigkeitsforschung nimmt Edenhofer ins Visier: „Wenn wir die Zellen künstlich altern lassen können, können wir sie auch verjüngen?“ Damit spricht der Biologe von der Idee, das Entwicklungsprogramm der Zellen zurückzustellen: Alte, ausdifferenzierte Neuronen würden so in Gehirnstammzellen umprogrammiert – das gäbe dem Hirngewebe die Fähigkeit, sich zu erneuern. Diesem großen Ziel nähert sich das Forschungsteam jetzt in ersten Schritten, wie Edenhofer berichtet: „Dafür nutzen wir einen Gen-Cocktail, von dem wir wissen, dass er Zellen in Mäusen umprogrammieren kann. Wir haben erste Hinweise, dass dieser ‚Verjüngungscocktail‘ die epigenetische Erosion der Neuronen rückgängig macht.“
Bis es eine Verjüngungskur für das Gehirn als Medikament gibt, wird noch viel Zeit vergehen, glaubt Edenhofer. Die Vorstellung, Altern als Krankheit zu betrachten, sieht er kritisch: „Es gibt einen großen Unterschied zwischen normalen und krankhaften Alterserscheinungen.“ Ein Ziel der Wissenschaftler:innen ist, Letztere zu heilen, aber auch durch gezielte präventive Maßnahmen das normale Altern zu verzögern. „Vielleicht ist es eines Tages möglich, gezielt die Prävention mit Medikamenten zu unterstützen. Unsere Forschung hilft uns zu verstehen, wie unser tägliches Verhalten – zum Beispiel Ernährung und Bewegung – die Epigenetik und die mitochondriale Fitness beeinflusst.“ Vorerst bleibt der beste „Jungbrunnen“ also ein aktiver Lebensstil – damit unser Gehirn möglichst gesund altert.
Zur Person
Frank Edenhofer ist Professor für Genomik und stellvertretender Vorstand des Instituts für Molekularbiologie an der Universität Innsbruck. Seine Arbeitsgruppe untersucht die molekularen Grundlagen von Krankheiten, mit Schwerpunkt auf Stammzellforschung und zellulärer Reprogrammierung, um neue regenerative Therapien zu ermöglichen. 2012 gelang seiner Gruppe an der Universität Bonn erstmals die Herstellung neuraler Stammzellen aus Hautzellen.
Das Projekt Ein Jungbrunnen fürs Gehirn wird 2025 abgeschlossen und vom Wissenschaftsfonds FWF im Rahmen des 1000-Ideen-Programms für innovative Projekte mit hohem transformativem Potenzial gefördert. Edenhofer ist auch Mitglied im Leitungskonsortium des FWF-Spezialforschungsbereichs „Stammzellmodulation in neuronaler Entwicklung und Regeneration“ (2020–2028).
Publikationen (Auswahl)
Spathopoulou A., Podlesnic M., De Gaetano L. et al.: Single-cell Profiling of Reprogrammed Human Neural Stem Cells Unveils High Similarity to Neural Progenitors in the Developing Central Nervous System, in: Stem Cell Reviews and Reports 2024
Beirute-Herrera J., López-Amo Calvo B., Edenhofer F., Esk Ch.: The promise of genetic screens in human in vitro brain models, in: Biological Chemistry 2024




