Neue Therapieansätze für schwere Hauterkrankung

Ichthyose, benannt nach dem griechischen Wort für Fisch, ist eine seltene genetische Krankheit, bei der die Haut Feuchtigkeit verliert und stark verhornt, sodass sich große Schuppen bilden. Es gibt leichte Formen, die ein normales Leben ermöglichen, aber auch schwere Formen, die zum Tod führen. Eine Heilung ist nicht möglich, die Symptome können mittels Bädern und Salben gelindert werden. Der Grazer Forscher Franz Radner konnte nun erstmals genauer untersuchen, wie der Gendefekt zur Krankheit führt.
Schutzschicht aus abgestorbenen Hautzellen
„Die Haut bildet die Abgrenzung des Körpers nach außen, als Schutz gegenüber Umwelteinflüssen und verhindert, dass das im Körper vorhandene Wasser unkontrolliert nach außen dringen kann, damit wir nicht austrocknen“, erklärt Radner. Jedes Landlebewesen besitzt so eine Barriere. Diese Wasserbarriere befindet sich ganz außen, in der sogenannten Hornschicht: „Diese besteht nicht aus lebenden Zellen, sondern aus abgestorbenen Hautzellen, die von einer Matrix aus Lipiden zusammengehalten werden.“ Lipide sind wasserabweisende Stoffe im Körper. Zu ihnen werden etwa auch die Fette gezählt. „Man kann sich diese Hautbarriere wie eine Ziegelmauer vorstellen“, erläutert der Forscher weiter, „die abgestorbenen Hautzellen sind die Ziegel, die Lipide bilden den Mörtel.“ Diese Schicht sei wasserabweisend und verhindere das Vertrocknen. Bei Menschen mit Ichthyose ist diese Schicht beschädigt.
Mörtel für die Schutzmauer der Haut
Im Rahmen eines vom Wissenschaftsfonds FWF finanzierten Projekts hat Radner nun untersucht, wie bestimmte Genmutationen mit Ichthyose zusammenhängen. „Wir haben uns das sogenannte PNPLA1-Gen angesehen, von dem bekannt ist, dass eine Mutation sowohl bei Menschen, als auch bei Hunden zu Ichthyose führt“, erklärt Radner. PNPLA1 ist ein Eiweiß in der Haut, dessen Funktion bislang nicht genau bekannt war. Ist das genannte Gen beschädigt, wird PNPLA1 nicht produziert. „Dass eine Beschädigung des Gens zu Ichthyose führt, konnten wir in früheren Arbeiten zeigen“, so Radner. Um den Effekt jedoch genauer zu untersuchen, veränderte er nun das Erbgut von Mäusen und schaltete das PNPLA1-Gen aus. „Wir haben uns dann die Lipide in der Haut genauer angesehen und konnten feststellen, dass das Lipid Acylceramid fehlt. Die Vorstufen des Lipids, sogenannte Omega-Hydroxyceramide, traten aber stark gehäuft auf“, sagt Franz Radner. Letztere sollten eigentlich mit Linolsäure zu Acylceramid reagieren, einem wichtigen Bestandteil des erwähnten „Hautmörtels“. Doch dieser Schritt schien nicht funktioniert zu haben, und die Haut entwickelte die für Ichthyose typischen Schuppen. „Daraus konnten wir schlussfolgern, dass für diesen Schritt das PNPLA1-Gen notwendig ist.“
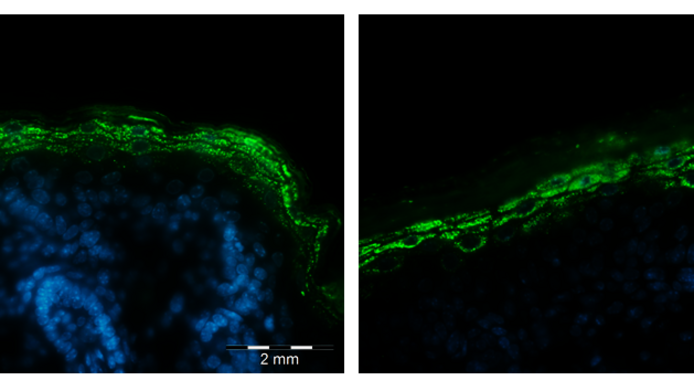
Damit ist es dem Mikrobiologen der Universität Graz gelungen, eine Lücke im Verständnis der Ausbildung der Hautbarriere in gesunder Haut zu schließen. „Der letzte Schritt in der Produktion von Acylceramid war lange nicht bekannt, vor allem, welches Protein die Reaktion der Hydroxyceramide mit Linolsäure ermöglicht. Wir konnten zeigen, dass PNPLA1 hier eine entscheidende Rolle spielt.“
Neue Behandlungsmöglichkeit
Ichthyose ist als genetische Krankheit nicht heilbar, aber das genauere Verständnis des Defekts bringt neue Ansätze für eine bessere Behandlung, wie Radner betont. „Wir haben gezeigt, dass an Ichthyose erkrankte Mäuse mit Lipiden aus der Haut von gesunden Mäusen effektiv behandelt werden können.“ Diese Behandlung setze, im Gegensatz zu den bisherigen Symptombehandlungen, direkt bei dem Gendefekt an. In Zukunft wären etwa Hautcremen mit synthetischem Acylceramid denkbar. „Damit wäre erstmals eine evidenzbasierte Behandlung möglich“, so Radner.
Auch für alternde Haut
Ob die neuen Erkenntnisse in die Entwicklung eines Medikaments fließen, sei derzeit nicht klar, sagt Radner. Ichthyose ist selten, die Wahrscheinlichkeit zu erkranken liegt nur bei etwa eins zu einer Million. Radner erinnert allerdings daran, dass auch bei alten Menschen die Fähigkeit, Acylceramid zu produzieren, reduziert ist, wodurch die Haut trocken und rissig wird. „Auch hier könnte man mit einer Behandlung durch Lipide entgegenwirken“, sagt der Forscher. Radner kam über Arbeiten zum Fettstoffwechsel zur Forschung an den Haut-Lipiden. Er untersuchte im Rahmen seiner Dissertation ein Gen namens ABHD5, das eine entscheidende Rolle im Fettstoffwechsel spielt. Dessen Mutation führt nicht nur zu fehlerhafter Fettspeicherung, sondern wie das PNPLA1-Gen auch zu Ichthyose. Im Laufe dieses Projekts konnte Radner zeigen, dass ABHD5 und PNPLA1 miteinander interagieren. In einem Folgeprojekt will er das Zusammenspiel nun genauer untersuchen.
Zur Person Franz Radner studierte Mikrobiologie an der Karl-Franzens-Universität Graz. Nach seiner Dissertation forschte er als Postdoc in Deutschland am Universitätsklinikum Freiburg an seltenen genetischen Hauterkrankungen. Seit 2013 ist Radner unabhängiger Forschungsgruppenleiter am Institut für Molekulare Biowissenschaften der Universität Graz. Er interessiert sich für Zellbiologie, insbesondere für den Lipidstoffwechsel der Haut.
Publikationen





