„Das Wichtigste ist, Neugier zu fördern“

Herr Winter, unsere Zellen brauchen Proteine als Bausteine. Sie beschäftigt als Forscher allerdings nicht deren Herstellung, sondern ihr Abbau. Wieso ist das wichtig?
Georg Winter: Der Abbau von Bausteinen ist in biologischen Kontexten immer relevant. In unseren Zellen herrscht ein ständiges Wechselspiel zwischen der Synthese und der Beseitigung von Grundelementen. Proteine, als einer der wichtigen Bausteine, werden auf verschiedene Arten abgebaut. Manche der Mechanismen sind streng reguliert, um zum Beispiel auf Umwelteinflüsse reagieren zu können. Andere laufen im Hintergrund und funktionieren als Qualitätskontrolle, etwa wenn Proteine falsch hergestellt wurden. All diese Prozesse sind wichtig, um Zellen intakt zu halten. Wird der Abbau durch Mutationen blockiert oder aus dem Gleichgewicht gebracht, dann ist das oft die Ursache für die Entstehung von Krankheiten, zum Beispiel von Krebserkrankungen wie Leukämie. Durch die Forschung an sogenannten Degradern können wir Proteine gezielt eliminieren. Unter anderem solche, die von Krebszellen gebraucht werden, um zu wachsen und sich zu teilen.
Wie kann man sich diesen Mechanismus vorstellen?
Winter: Im Prinzip ist die Idee, zwei Interaktionspartner in räumliche Nähe zu bringen: das zu entfernende Zielprotein und die zelluläre Maschinerie für den Proteinabbau, konkret die sogenannten E3-Ubiquitin-Ligasen. Diese Ligasen können dann das Zielprotein für den Abbau markieren. Dazu hängen sie ein anderes, kleineres Protein namens Ubiquitin daran. Man kann sich das so vorstellen, als würden die E3-Ligasen Post-its an das zu entfernende Protein kleben. Wenn ein Protein mit drei Ubiquitinen in Serie markiert ist – also drei Post-its aufeinander kommen –, dann ist das für die Zelle das Zeichen, dieses Protein dem Abbau zuzuführen. Die Ubiquitinierung bezeichnet man deshalb auch als kiss of death. Mit den Degradern verfolgen wir das Ziel, diese Markierungen spezifisch auf krankheitsauslösenden Proteinen anzubringen.
Wie sehen solche Degrader aus?
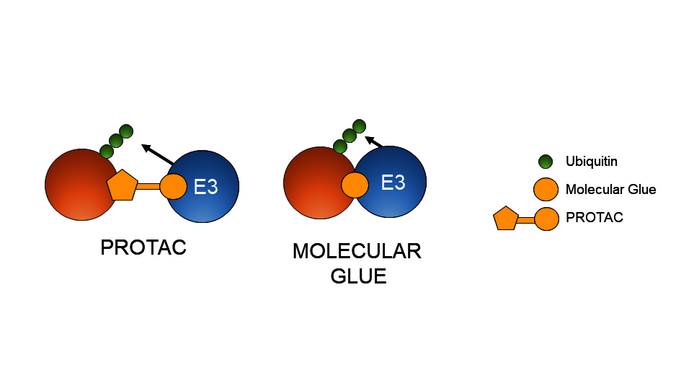
Winter: Es gibt verschiedene Arten, die kleinen Moleküle, die als Degrader funktionieren, zu entwerfen. Zur groben Unterscheidung gibt es die Gruppe der sogenannten PROTACs, an denen ich während meines Aufenthalts als Postdoktorand in den USA gearbeitet habe. Hier wird die Bindung zwischen der E3-Ligase und dem Zielprotein relativ simpel hergestellt: PROTACs haben für jeden der zwei Interaktionspartner jeweils eine Bindungsseite, die durch einen Linker verbunden ist. So können sie gleichzeitig an das Zielprotein und die Abbaumaschinerie binden und sie zusammenbringen.
Bei Proxygen interessiert uns aber die Gruppe der sogenannten Molecular Glue Degraders, kurz Molecular Glues. Diese sind im Design ein wenig komplizierter, weil sie nur an einen der beiden Partner binden und dadurch dessen Oberfläche verändern. Wählt man ihre Architektur richtig, dann verändern sie die Bindungsstelle so, dass das zweite Protein dorthin gezogen wird.
Weshalb sind Molecular Glues aus Ihrer Sicht interessanter?
Winter: Zum einen sind sie kleinere Moleküle und deshalb besser geeignet, um oral verfügbare Medikamente herzustellen. Zum anderen müssen wir bei ihnen keine spezifische Bindungsseite für das Zielprotein schaffen. Das ist der biologisch wirklich spannende Punkt. Wir stellen uns Proteine oft wie kleine Kugeln mit Einbuchtungen vor. Tatsächlich ähneln viele Proteine aber eher langen Spaghetti aus ungefalteten Ketten von Aminosäuren. Für solche Proteine lässt sich schwer eine Domäne finden, an die PROTACs oder klassische Arten von Medikamenten wie Inhibitoren binden können. Weil Molecular Glues eine solche spezifische Bindungsstelle nicht brauchen, wird der erschließbare Raum an Proteinen viel größer. Das ist ihre Stärke.
Auf Basis dieser Überlegungen kam es 2020 zur Gründung von Proxygen. Was genau ist die Idee des Unternehmens?
Winter: Bei Proxygen versuchen wir die Lücke an Proteinen zu schließen, die mit herkömmlichen Medikamenten schlicht nicht angreifbar sind. Unser Ansatz ist im Gegensatz zu anderen also nicht darauf ausgerichtet, einzelne Krankheitsursachen umzukehren. Stattdessen wollen wir den Mechanismus des Proteinabbaus umprogrammieren, indem wir über die Chemie darauf zugreifen. Um das zu erreichen, rationalisieren wir die Strategien, mit denen sich Molecular Glues finden lassen. Denn traditionell ist man auf solche Moleküle eher zufällig gestoßen.
Inwiefern hat die Grundlagenforschung zum Konzept von Proxygen beigetragen?
Winter: Aus unseren wissenschaftlichen Projekten konnten wir wichtige Einsichten zu den verschiedenen Arten von Degradern gewinnen. Außerdem haben wir Möglichkeiten entdeckt, Molecular Glues schnell zu finden und zu charakterisieren. Zum Beispiel konnten wir 2019 in einer Publikation zeigen, dass es einen genetischen Schalter gibt, mit dem sich 300 der insgesamt etwa 600 E3-Ligasen auf einmal ein- bzw. ausschalten lassen. 2020 folgte dann eine Publikation, in der wir beschrieben haben, wie man diesen Mechanismus für die Suche nach Molecular Glues verwenden kann.
„Uns wurde schnell klar, dass diese Herangehensweise bahnbrechendes Potenzial hatte.“
Uns wurde schnell klar, dass diese Herangehensweise bahnbrechendes Potenzial hatte, welches wir aber im akademischen Umfeld allein nicht nutzbar machen hätten können. Mittlerweile ist daraus eine der Methoden entstanden, die wir heute bei Proxygen anwenden. Allerdings ist der Prozess nicht so linear, wie es hier den Anschein hat. Die Kernkonzepte, die wir bei Proxygen anwenden, stammen eher indirekt aus unseren wissenschaftlichen Projekten – und anders wäre es in meinen Augen auch nicht wünschenswert. Wir sollten die Grundlagenforschung nicht darauf ausrichten, im Anschluss ein Unternehmen daraus zu machen.
Welche Rolle können Förderungen wie die vom FWF dann spielen?
Winter: Die FWF-Förderungen waren für mich initial essenziell, um mein Labor zu starten und dann skalieren zu können. Das waren die wichtigsten Grants, die ich bekommen habe, weil es die ersten waren. Über die Forschungsförderungen habe ich versucht, molekulare Mechanismen so genau wie möglich zu verstehen, und zwar ohne dass schon eine Anwendbarkeit dahinterstand. Das Wichtigste ist, Neugier zu fördern. Subsumiert man die Lernkurven aus den einzelnen Projekten, dann ergibt das eine Wissensbasis, auf der sich Größeres aufbauen lässt. Wenn man Medikamente entwickeln will, ist dieses mechanistische Verständnis elementar.
„Mit jedem Erfolgsmodell, das in Österreich hinzukommt, wird der Standort für kompetente Menschen attraktiver.“
Ein anderer Aspekt der Förderungen ist, dass wir damit Talente aufbauen können. Zum Beispiel ist Matthias Brand – der erste Student, den ich in meinem Labor am CeMM (Forschungszentrum für Molekulare Medizin) betreut habe – heute Co-Gründer und Chief Scientific Officer von Proxygen. Letztlich geben die Publikationen aus solchen Projekten uns auch Glaubwürdigkeit, weil sie die Expertise belegen, die wir als Gründer der Firma in dem Feld haben. Das ist für Proxygen im Vergleich zu anderen Firmen, die einen ähnlichen Ansatz verfolgen, zweifelsohne ein großer Wettbewerbsvorteil.
Welche Auswirkungen haben Investitionen wie die von MSD auf den Forschungsstandort Wien bzw. Österreich?
Winter: Solche Kooperationen sind förderlich, weil sie zeigen, dass österreichische Firmen aus dem lokalen Biotop herauswachsen und global mitspielen können. Besonders merkt man den Effekt bei der Rekrutierung neuer Mitarbeiterinnen und Mitarbeiter. In Wien gibt es zwar talentierte junge Menschen, aber viele sind in der Biotech-Branche noch unerfahren. Im Vergleich mit Hotspots wie Boston, San Francisco oder Basel ist es bei uns schwieriger, erfahrene Mitarbeitende zu finden. Mit jedem Erfolgsmodell, das in Wien oder Österreich hinzukommt, wird der Standort für kompetente Menschen attraktiver, um den Schritt zu wagen und hier Wurzeln zu schlagen.
Was bedeutet die Zusammenarbeit mit MSD für Proxygen?
Winter: Für uns ist es die dritte Kooperation mit einem Pharmakonzern – nach Kollaborationen mit Boehringer Ingelheim und Merck in Deutschland. Solchen Kooperativen geht ein langer Prozess voran, in dem das Start-up und die Leute, die dahinterstehen, genau geprüft werden. Insofern ist es für Proxygen eine große Auszeichnung, wenn sich globale Player für eine Zusammenarbeit mit uns entscheiden, und wir sind dementsprechend stolz darauf. Aber man darf nicht vergessen, dass das erst der Anfang des gemeinsamen Projekts ist. Jetzt gilt es, sich als Partner zu bewähren. Unser Feld ist global sehr kompetitiv und erfährt derzeit einen großen Aufschwung. Das bedeutet, wir müssen auch in Zukunft neue Ideen einbringen, um weiterhin zu den innovativsten Firmen zu gehören.
Zur Person
Georg Winter promovierte am CeMM Forschungszentrum für Molekulare Medizin der Österreichischen Akademie der Wissenschaften in Wien, bevor er 2013 als Postdoktorand an die Harvard Medical School nach Boston wechselte. 2016 kehrte er als Principial Investigator zurück ans CeMM und gründete 2020 gemeinsam mit Matthias Brand, Stefan Kubicek und Giulio Superti-Furga das Biotech-Start-up Proxygen. Im April 2023 gab Proxygen eine Kooperation mit dem US-Pharmakonzern MSD bekannt, einem der größten Arzneimittelherzsteller weltweit, mit einer Investitionssumme von rund 2,3 Mrd. Euro.





