Der Ur-Ozean als ideale Brutstätte für Leben

Das vielleicht größte Rätsel der Wissenschaft ist der Ursprung des Lebens. Wie etwas derartig Komplexes aus unbelebter Natur hervorgehen konnte, ist nach wie vor nicht ausreichend verstanden. Der Biochemiker Markus Keller von der Medizinischen Universität Innsbruck hat nun einen wichtigen Beitrag zum Verständnis der Entstehung des Lebens auf der Erde geleistet. Im Rahmen eines vom Wissenschaftsfonds FWF finanzierten Erwin-Schrödinger-Auslandsstipendiums untersuchte er, wie sich einige sehr alte und komplexe Prozesse des Zellstoffwechsels entwickeln konnten. – Prozesse, die fast vier Milliarden Jahre alt sind und auch im menschlichen Organismus ablaufen. „Es geht um die Frage, wie der Stoffwechsel begonnen hat“, sagt Keller im Gespräch mit scilog. „An einigen Orten auf der Erde gibt es sehr alte Sedimente, die uns zeigen, dass das Leben vor mehr als 3,7 Milliarden Jahren entstanden ist. Von diesen Sedimenten selbst kann man allerdings nicht darauf rückschließen, welche Arten das genau waren und welche Eigenschaften sie hatten. Wir wissen nur, dass es irgendeine Form von Stoffwechsel gegeben haben muss“, so Keller. Einige Wege des Zellstoffwechsels sind bei nahezu allen Lebewesen auf der Erde gleich. Ein Beispiel ist die „Glykolyse“, die Verarbeitung von Zucker. „Pflanzen, Bakterien und andere Lebewesen verwenden Glucose auf die gleiche Art und Weise wie wir. Wir können annehmen, dass Lebewesen das bereits zu sehr frühen Stadien der Evolution so gemacht haben. Die Frage ist: Wie waren diese Lebensformen in der Lage, die Zwischenprodukte der Glykolyse ineinander umzuwandeln?“
Rätsel um fehlende Enzyme
Der Zellstoffwechsel ist ein kompliziertes System, das auf eine Reihe von Enzymen angewiesen ist. – Das sind spezielle Proteine, die als Katalysatoren fungieren und viele der Vorgänge erst ermöglichen. Fehlt ein Enzym, funktioniert der gesamte Kreislauf nicht. Es handelt sich, wie Keller erklärt, um ein „Henne-Ei-Problem“: Wer war zuerst da? Die Enzyme, die selbst Stoffwechselprodukte sind? Oder der Stoffwechsel, der ohne die Enzyme nicht funktioniert? Die Vorstellung, mehrere dieser Stoffwechselmechanismen könnten ohne Enzyme gleichzeitig funktioniert haben, rein aufgrund der Umgebungsbedingungen, wurde noch vor wenigen Jahren als „Zauberei“ abgetan. Genau diese Vorgänge konnte Keller aber nachweisen.
Wichtiges Eisen im Ur-Ozean
Die ersten Arbeiten befassten sich mit der Glykolyse und dem sogenannten „Pentose-Phosphat-Weg“. „Der Ur-Ozean zu der Zeit, in der erstes Leben entstanden sein muss, war zum einen relativ warm, zum anderen lag sehr viel Eisen in gelöstem Zustand vor“, erklärt Keller. Eisen ist in seiner oxidierten Form, als Rost, eigentlich nicht wasserlöslich. Vor knapp vier Milliarden Jahren gab es in der Atmosphäre und im Meer aber noch kaum reinen Sauerstoff, um die Oxidation des Eisens voranzutreiben. Es existierten daher große Mengen an Eisen (II), einem bestimmten Eisensalz, das leicht wasserlöslich ist. „Wir haben die Bedingungen des Ur-Ozeans nachgestellt und uns angesehen, wie sich zum Beispiel Fructose-6-Phosphat, ein Zwischenprodukt des Zellstoffwechsels, in diesem Umfeld verhält. Dabei konnten wir feststellen, dass es sich unter anderem in Glucose-6-Phosphat umwandelt. Das sind genau die gleichen Reaktionsfolgen und Reaktionswege wie in der lebenden Zelle. In den ersten Publikationen haben wir gezeigt, dass dies überraschend effizient abläuft, wir haben sehr wenige Seitenreaktionen. Es entstehen genau die richtigen Moleküle.“
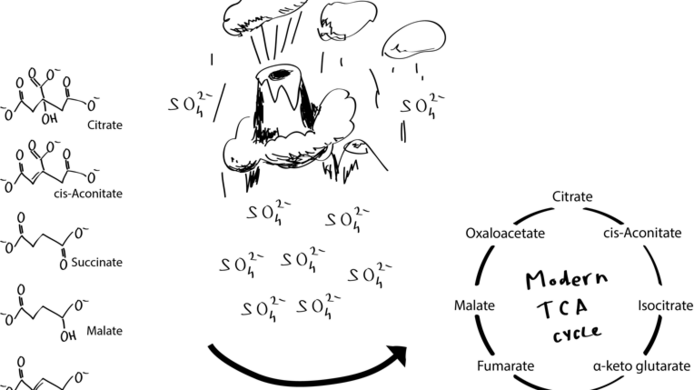
Zuerst Stoffwechselprozesse, dann Enzyme
Der damalige Ur-Ozean war also ein geradezu ideales Umfeld für diese sehr alten Stoffwechselreaktionen. Das ist die Lösung des Henne-Ei-Problems: Chemische Stoffwechselwege waren zuerst da, die Enzyme bildeten sich später. Erst kürzlich konnte Keller Ähnliches auch für den „Citratzyklus“ zeigen, einen weiteren wichtigen Stoffwechselprozess der Zelle. Auch deren Einzelreaktionen können ohne die Anwesenheit von Enzymen ablaufen. In Analogie zu modernen Zellen, in denen Glykolyse und der in den Mitochondrien der Zelle angesiedelte Citratzyklus getrennt voneinander in unterschiedlichen Milieus ablaufen, benötigen auch ihre nicht-enzymatischen Ebenbilder verschiedene chemische Umfelder, um effektiv ablaufen zu können. Damit konnte gezeigt werden, dass die ursprünglich für die Glykolyse getätigten Beobachtungen auch für weitere wichtige Stoffwechselwege gültig sind.
Neue Methoden führen zur Idee
Möglich waren diese Beobachtungen mithilfe von Massenspektrometrie-Methoden, die Keller im Rahmen des Schrödinger-Stipendiums an der Universität Cambridge entwickelt hat. Massenspektrometrie ist eine extrem sensible Messmethode, bei der Stoffe in ihre einzelnen Moleküle oder Atome zerlegt werden und deren Masse gemessen wird. Keller untersuchte ursprünglich, wie sich die Bestandteile von Hefezellen mit Massenspektrometrie analysieren lassen, die neben hoher Genauigkeit einige Vorteile gegenüber anderen Methoden versprach. Hefe ist einer der wichtigsten Modellorganismen der Biologie, es handelte sich um Grundlagenforschung zur Entwicklung von Methoden für andere Forschungen. Die Idee, sich den evolutionären Ursprung des Zellstoffwechsels anzusehen, entstand gemeinsam mit dem Mikrobiologen Markus Ralser, in dessen Gruppe in Cambridge Keller forschte. Man zog Alexandra Turchyn hinzu, eine Expertin für Urozeane, und publizierte gemeinsam die erste Arbeit dazu.
Wichtige Nebenbeobachtungen
„Dass die Forschungen in diese Richtung gehen, war eigentlich nicht geplant“, sagt Keller. „Die ursprüngliche Arbeit zum Hefestoffwechsel ist mittlerweile ebenfalls auf dem Weg zur Publikation. Es war aber wichtig, dass ich die Freiheit hatte, mir diese Dinge ansehen zu können. Anfangs war das nur eine Nebenbeobachtung.“ Keller betont, dass manche dieser Effekte wahrscheinlich schon in anderen Studien als Nebeneffekte gemessen wurden, allerdings ohne davon in der Literatur im Detail davon zu berichten. „Diese Reaktionen passieren in heutigen Zellen immer noch“, sagt Keller. Er ermutigt die Gruppen, die in diesem Bereich aktiv sind, sich vermeintliche Messungenauigkeiten genauer anzusehen.
Zur Person Markus Keller ist Biochemiker an der Sektion für Humangenetik der Medizinischen Universität Innsbruck. Sein Interesse gilt der Untersuchung von Steuerung, Eigenschaften und Evolution des zellulären Stoffwechsels, insbesondere den Reaktionsmechanismen in der Abwesenheit von Enzymen, sowie dem Energie- und Membranlipid-Metabolismus in modernen Organismen. Von 2012 bis 2015 forschte er im Rahmen eines Erwin-Schrödinger-Auslandsstipendiums des FWF an der Universität Cambridge.
Publikationen




