Biobank gibt Aufschluss über Therapieresistenz bei Prostatakrebs

Die Diagnose Prostatakrebs ist für Betroffene ein Schock, doch bei frühzeitiger Erkennung stehen die Chancen auf Heilung gut. „Solange der Tumor lokal begrenzt ist, können eine operative Entfernung oder eine Strahlentherapie sehr gute Ergebnisse erzielen“, erklärt Natalie Sampson, Forscherin an der Universitätsklinik für Urologie der Medizinischen Universität Innsbruck. Wird der Tumor jedoch nicht rechtzeitig erkannt oder kehrt er nach einer Behandlung zurück, kann er sich ausbreiten und Resistenzen gegen die verbleibenden Therapieoptionen entwickeln.
Diese Therapieresistenz ist der Hauptgrund dafür, dass Prostatakrebs nach wie vor eine der häufigsten Krebstodesursachen bei Männern ist. Der Wissenschaftsfonds FWF fördert Sampsons Forschungsprojekt „Therapieresistenz beim Prostatakarzinom“, ein Kooperationsprojekt mit einer Forschungsgruppe aus Bern, das die Mechanismen hinter der Resistenz untersucht. Durch die österreichische Beteiligung am Projekt ist es Sampsons Team nun gelungen, eine umfangreiche Biobank mit Patientenmaterial aufzubauen. Dabei untersuchen sie nicht die Tumorzellen selbst, sondern Zellen aus dem umgebenden Bindegewebe. Die Erkenntnisse könnten auch für andere Krebsarten wegweisend sein.
Neue Biobank zeigt Stadien des Krebsfortschritts
„Unsere Biobank umfasst mehr als 400 Zelllinien von tumorassoziierten Bindegewebszellen, Fibroblasten, aus über 100 Patientenproben. Das bietet uns eine Plattform, um das Fortschreiten des Krebses zu untersuchen und neue Medikamente zu testen“, sagt Sampson. Bereits jetzt konnte das Team in dem Probenmaterial bestimmte Subtypen der krebsassoziierten Fibroblasten identifizieren. Die Forschenden vermuten, dass die entdeckten Zelltypen einen entscheidenden Einfluss auf den Krankheitsverlauf und die Resistenzentwicklung haben. Die Ergebnisse werden derzeit zur Publikation aufbereitet.
Insgesamt verdeutlichen die gesammelten Zelllinien, welche dynamischen Veränderungen das Tumorumfeld durchläuft. So schütten die umgebenden Bindegewebszellen im frühen Tumorstadium entzündungsfördernde Botenstoffe aus und tragen eher dazu bei, die Krebsentwicklung zu bremsen. Im weiteren Verlauf wandeln sie sich jedoch in tumorfördernde Subtypen um und bilden unter anderem das Matrixgewebe des Tumors, das ihm seine Festigkeit verleiht, vor dem Zugriff von Immunzellen schützt und die Medikamentenaufnahme durch die Tumorzellen beeinträchtigt. Gleichzeitig verändern sich die Bindegewebszellen hinsichtlich ihrer Empfindlichkeit gegenüber aktuellen Therapieansätzen.
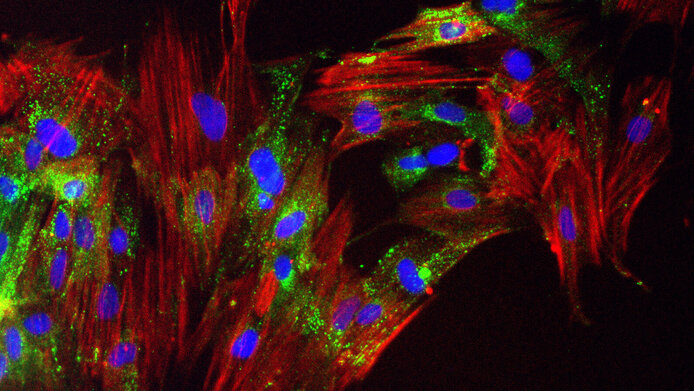
Eine neue Biobank enthält mehr als 400 Zelllinien von Bindegewebsproben, die über 100 Patienten mit Prostatakrebs entnommen wurden.
Im Umfeld der Krebszellen suchen Wissenschaftler:innen nach neuen Ansätzen für die Medikamentenentwicklung. Die Biobank soll auch dazu beitragen, Resistenzen früher zu entdecken.
Der Androgen-Rezeptor als Schlüsselfaktor
„Die Prostata ist ein Zielorgan im Hormonsystem und hängt von männlichen Steroidhormonen wie Androgen ab. Deshalb versucht man in der Therapie, die Wirkung dieses Hormons auf die Tumorzellen zu hemmen“, erläutert Sampson eine der wichtigsten verbleibenden Optionen, wenn Operation oder Bestrahlung erfolglos bleiben. Es zeigt sich aber, dass der früh aktivierte Subtyp der krebsassoziierten Fibroblasten ebenfalls den Rezeptor für Androgen trägt. In späteren Stadien der Aktivierung von Fibroblasten wird die Produktion dieses Rezeptors unterdrückt, wodurch dieser tumorfördernde krebsassoziierte Fibroblasten-Subtyp resistent gegen Androgen-gerichtete Therapien macht.
Somit könnten Therapieansätze, die auf den Androgen-Rezeptor der Krebszellen abzielen, ungewollt zum Fortschreiten des Tumorumfelds führen, vermutet Sampson. Die Forscherin plädiert für ganzheitliche Therapieansätze: „Tumoren sind komplexe Ökosysteme, die auf Kommunikationsnetzwerke zwischen verschiedenen Zelltypen angewiesen sind. Es reicht nicht aus, nur die Tumorzellen zu behandeln. Wir müssen auch die Interaktionen mit dem umliegenden Gewebe kappen, um den Tumorzellen diese kritischen Fluchtwege zu entziehen, damit die verfügbaren Therapien besser wirken können.“
Perspektivenwechsel in der Krebstherapie
Für Sampson ist wesentlich, dass die Erforschung einzelner Krebsarten auch zum Verständnis der fundamentalen Mechanismen von Krebs beiträgt. „Unsere Erkenntnisse über den Umbau des Bindegewebes gelten nicht nur für das Prostatakarzinom, sondern auch für andere solide Tumoren“, betont sie. Die Erforschung der Mikroumgebung von Tumoren hat in den letzten Jahren einen Perspektivenwechsel in der Krebstherapie bewirkt. Weltweit laufen zahlreiche klinische Studien zu verschiedenen Krebsarten. Sie untersuchen, wie sich Strategien gegen Tumorzellen mit Ansätzen kombinieren lassen, die auf die Tumormikroumgebung abzielen.
„Mit unserer Biobank können wir zur Medikamentenentwicklung beitragen. Derzeit testen wir Wirkstoffe auf ihre Fähigkeit, den Übergang vom frühen zum späten Aktivierungsstadium der Fibroblasten zu verhindern. Wir sind sogar in der Lage, fortgeschrittene Stadien in eine deaktivierte Form zurückzuverwandeln – vorerst nur im Labor“, beschreibt Sampson die Anwendungsmöglichkeiten. Darüber hinaus beschäftigt die Forscherin die Frage, wie sich Resistenzen frühzeitig erkennen lassen. Sie hofft, dass die Biobank und das Verständnis über die Aktivierungsstadien von Fibroblasten zu neuen Methoden führen, um Patienten rechtzeitig über ein erhöhtes Risiko zu informieren. „Die Biobank ist eine wertvolle Ressource und für unsere Forschung ein großer Schritt in die richtige Richtung. Dafür sind wir auch den Patienten dankbar, die bereit waren, Gewebe für die Forschung zur Verfügung zu stellen“, betont Sampson.
Zur Person
Natalie Sampson ist Molekularbiologin und leitet eine Forschungsgruppe an der Medizinischen Universität Innsbruck im Bereich Urologie. Ihre Forschung beschäftigt sich mit der Entwicklung von Prostatakarzinomen. Damit will Sampson zum Verständnis der grundlegenden Mechanismen von Krebserkrankungen beitragen. Das Projekt „Therapieresistenz beim Prostatakarzinom“ läuft bis Mitte 2025 und wird vom Wissenschaftsfonds FWF und dem Schweizerischen Nationalfonds gefördert. Der Beitrag des FWF beläuft sich auf rund 400.000 Euro.
Publikation
Kang J., La Manna F., Bonollo F., Sampson N. et al: Tumor microenvironment mechanisms and bone metastatic disease progression of prostate cancer, in: Cancer Letters 2022





