Wie „gutes Cholesterin“ noch fleißiger wird

Fettleibigkeit (Adipositas) und starkes Übergewicht sind bekannte Risikofaktoren für die Entstehung von Krebs im Verdauungsapparat, vor allem im Dickdarm und in der Bauchspeicheldrüse. „Es sind sicher multiple Stoffwechsel-Parameter, die bei starkem Übergewicht aus dem Gleichgewicht kommen. Man weiß, dass Fettgewebe nicht nur Fett speichert, sondern hormonell aktiv ist. Ebenfalls bekannt ist, dass sich Blutfett-Spiegel und die Zusammensetzung der Blutfette von metabolisch fitten und fettleibigen Menschen unterscheiden“, beschreibt der Molekularbiologe Raimund Bauer die Ausgangssituation. Übergewicht, verursacht durch eine stark verarbeitete hochkalorische, fett- und kohlenhydratreiche Ernährung quer durch alle Altersgruppen, ist seit den 1970er-Jahren auf dem Vormarsch. Der Anteil fettleibiger Personen wird in den USA aktuell auf mehr als 30 Prozent, in Europa auf rund 20 Prozent geschätzt. Gefördert durch ein Erwin-Schrödinger-Auslandsstipendium des Wissenschaftsfonds FWF untersuchte Raimund Bauer am Hamburger Universitätsklinikum Eppendorf (UKE), wie HDL-Partikel in der Mikroumgebung von Tumoren wirken.
Die Struktur bestimmt die Funktion
Gearbeitet wurde mit Mäusen, denen das Hauptstrukturprotein von HDL, das Apolipoprotein A-1 (APOA-1) fehlt, und die somit stark reduzierte HDL-Spiegel im Blutplasma aufweisen. Normalerweise setzen Leberzellen das HDL-Strukturprotein APOA-1 frei, an das sich Lipidkörper anlagern, worauf der fertige Partikel in die Blutbahn entlassen wird. Zu den Aufgaben von HDL gehört u.a. überschüssiges Cholesterin aus der Peripherie des Körpers abzuziehen und zur Ausscheidung zurück in die Leber zu transportieren. In den Versuchen stand zunächst die Wirkung von HDL auf die Gefäßneubildung in Tumoren im Fokus, wobei sich keine direkten Effekte zeigten, jedoch spannende Projekte entstanden, an denen erfolgreich weiter geforscht wurde (siehe Publikationen). In der Folge legte der Forscher das Augenmerk auf die direkte Interaktion von HDL mit den Tumorzellen: „Die Struktur der HDL-Partikel bestimmt die Funktion in der Wechselwirkung mit dem Tumor. Das konnten wir zeigen, indem wir stark Cholesterin-abziehende HDL-Partikel zum Einsatz brachten“, erklärt Raimund Bauer, der seine Forschung nach der Rückkehr nun am Institut für Medizinische Chemie und Pathobiochemie der Medizinischen Universität Wien fortführt.
Wie fleißige HDL-Partikel aussehen
Aus dem pauschal als „gut“ bewerteten HDL-Cholesterin kann noch fleißigeres HDL werden, wenn die Ladekapazität der Partikel für den Cholesterin-Abtransport gesteigert wird. Die „Cholesterin-abziehende“ Wirkung zeigte sich zum einen bei rekonstituierten HDL-Partikeln, für die APOA-1 mit einer Phospholipid-Hülle biochemisch zusammengefügt wird. Auch über den Umweg einer simulierten viralen Infektion von Leberzellen, die daraufhin APOA-1 Strukturproteine im Übermaß produzierten, zeigte sich eine protektive Wirkung bei Bauchspeicheldrüsenkrebs.
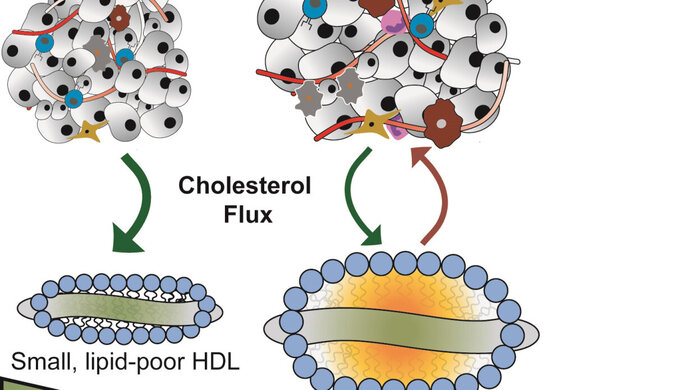
Diese speziellen HDL-Partikel reduzierten die Wachstumsgeschwindigkeit der Tumore in Mäusen und hemmten die Zellteilung des Pankreaskarzinoms in Kultur. „Ein hoher HDL-Spiegel allein verlangsamt nicht zwingend das Tumorwachstum. Die Cholesterin-abziehende Wirkung und die Interaktion mit den Rezeptoren der Tumorzellen sind aber zentrale Mechanismen wie HDL das Tumorwachstum reduziert. Wenn man es therapeutisch einsetzen will, müssen Struktur und Menge gezielt beeinflusst werden“, erklärt Raimund Bauer die Ergebnisse seiner Untersuchungen. Künftig will sich Bauer in Zellkulturen die Interaktion der HDL-Fettpartikel mit den Krebszell-Rezeptoren ansehen. Es ist anzunehmen, dass diese Lipoproteine bei fettleibigen Menschen ihre Funktion nicht oder nur unzureichend ausführen können. In Zusammenarbeit mit Jörg Heeren vom UKE in Hamburg will der Stoffwechselexperte künftig erkunden, worin sich die Fettpartikel metabolisch fitter und stark übergewichtiger Menschen in Bezug auf ihre tumorblockierende Aktivität unterscheiden. Grundsätzlich kann jeder Einzelne seine Blutfettwerte mit Sport und einer ausgewogenen Ernährung beeinflussen.
Zur Person Raimund Bauer studierte Genetik und Mikrobiologie an der Universität Wien und promovierte an der Medizinischen Universität Wien im Bereich Fettstoffwechsel und Entwicklungsbiologie. Mit einem FWF-Auslandsstipendium befasste er sich am Universitätsklinikum Hamburg drei Jahre mit dem Zusammenhang von Fettleibigkeit und Tumorerkrankungen. Seit Februar 2018 forscht Bauer wieder in Wien an der Medizinischen Universität.
Publikationen




